
Połączenie glinu z saletrą amonową to mieszanka wybuchowa. Naukowcy z UW, we współpracy z fizykiem z Uniwersytetu La Sapienza w Rzymie, sprawdzili, w jaki sposób skutecznie przeprowadzić kontrolowane reakcje redoksowe. Wyniki badań opublikowali w prestiżowym tygodniku „Angewandte Chemie – International Edition”.
Prof. Wojciech Grochala, dr Adam Grzelak z Centrum Nowych Technologii UW oraz dr José Lorenzana z Uniwersytetu La Sapienza w Rzymie i Consiglio Nazionale delle Ricerche opublikowali wyniki badań, w których przedstawili na gruncie obliczeń teoretycznych, w jaki sposób skutecznie przeprowadzić kontrolowane domieszkowanie związków chemicznych przy zachowaniu stechiometryczności chemicznej.
− Cieszę się, że udało się nam zrobić coś uniwersalnego. Nowy układ może zostać zastosowany do olbrzymiej gamy nieorganicznych oraz organicznych związków chemicznych i otwiera drzwi do wielu zastosowań − mówi prof. Wojciech Grochala z CeNT-u.
Spektakularne wybuchy
Wszystkie reakcje chemiczne można podzielić na dwa rodzaje: reakcje kwas-zasada oraz utleniania-redukcji. Te ostatnie nazywane są procesami redoksowymi. Ich główną cechę stanowi fakt przeskoku elektronu lub elektronów pomiędzy reagentami. Reakcje takie wyzwalają często bardzo dużo energii i nie dają się łatwo kontrolować – z reguły zachodzą gwałtownie i wyczerpują reagenty do końca.
Używanie do reakcji redoksowych tzw. silnych utleniaczy lub/i silnych reduktorów może się skończyć spektakularnym wybuchem z towarzyszącymi mu efektami świetlnymi, dźwiękowymi oraz falą uderzeniową. Na przykład, największe konwencjonalne bomby używane przez armię USA, zdolne do kruszenia stropów o grubości dziesięciu metrów, zawierają tylko dwie substancje: saletrę amonową (utleniacz) oraz glin (reduktor metaliczny). Tymczasem ani saletra amonowa, ani glin nie należą wcale do ekstremalnie silnych utleniaczy/reduktorów.
By zilustrować potęgę reakcji redoksowych można przywołać przykład reakcji między atomami cezu a atomami fluoru z utworzeniem krystalicznej soli, fluorku cezu. Okazuje się, że nawet gdyby nasz wszechświat, który zawiera (szacując górną granicę) ok. 1082 atomów, był złożony wyłącznie z równej ilości atomów cezu i fluoru, po reakcji i tak nie pozostałby ani jeden atom cezu i fluoru – reakcja byłaby w sensie dosłownym i matematycznym kompletna.
Kompletność reakcji redoksowych powoduje, że niemal wszystkie znane nauce związki chemiczne możemy sklasyfikować, przypisując atomom składowym tzw. formalne stopnie utlenienia. W opisywanym przykładzie są to stopień +1 dla cezu i –1 dla fluoru w krystalicznym fluorku cezu. Pozwala to na łatwe sklasyfikowanie związków chemicznych, w szczególności zawierających te pierwiastki, które mogą występować na kilku różnych stopniach utlenienia. Klasyfikacja wprowadza porządek w zbiorze kilkunastu milionów znanych związków chemicznych i ułatwia rozumienie, a także nauczanie chemii.
Układy domieszkowane
Istnieje jednak ciekawa, lecz bardzo wąska grupa związków chemicznych, w których pierwiastkowi wchodzącemu w skład związku nie sposób przypisać stopnia utlenienia w postaci liczby całkowitej. Przykładami takich związków są układy domieszkowane, czyli takie, w których do prekursora wprowadzono niecałkowitą (niestechiometryczną) ilość pewnego dodatku (domieszki). W tego typu układach wiele właściwości fizykochemicznych w sposób znaczący zależy od ilości domieszki, czyli od tzw. stopnia domieszkowania.
Zmieniając nieznacznie skład chemiczny możemy uzyskać diametralnie różne właściwości. Na przykład związek lantanu, baru, miedzi i tlenu o wzorze La2–δBaδCuO4 może być nadprzewodnikiem, metalem, przewodzić prąd elektryczny, wykazywać bardzo silne właściwości magnetyczne, a jednocześnie być izolatorem elektryczności lub nie wykazywać uporządkowania magnetycznego, w zależności od wartości parametru δ.
Rewolucje cywilizacyjne
Związki domieszkowane mają duże znaczenie technologiczne. Wytwarzane są z nich rozmaite przydatne człowiekowi urządzenia. Układy takie spowodowały w ciągu ostatnich trzech ćwierci wieku kilka prawdziwych rewolucji cywilizacyjnych:
- domieszkowany krzem, dzięki fabrykowaniu tzw. złączy n/p dał nam radia na tranzystorach, komputery krzemowe, baterie słoneczne i diody LED;
- organiczne polimery przewodzące przyczyniły się do produkcji wszechobecnych dziś kolorowych wyświetlaczy i ekranów;
- wspomniany La2–δBaδCuO4 zapoczątkował erę tzw. wysokotemperaturowego nadprzewodnictwa, co prowadzi do obniżenia kosztów związanych z przesyłaniem prądu elektrycznego, budowy silnych magnesów dla magnetycznego rezonansu jądrowego oraz konstrukcji lewitujących pociągów, a także do stworzenia ultraszybkich procesorów;
- stworzenia ultraszybkich procesorów;podobny La1–δCaδMnO3 wykazuje tzw. gigantyczną magnetooporność, co ma znaczenie w różnego typu miernikach i zaworach;
- domieszkowany diament, CBδ jest unikatowym materiałem, z którego tworzy się elektrody;
- LiδCoO2 posiada zdolność do gromadzenia litu w szerokim zakresie stężeń i przewodzenia jonów litu przez zdefektowaną sieć krystaliczną, co spowodowało dynamiczny rozwój baterii litowych.
− Nic dziwnego, że za badania takich materiałów oraz wytworzenie urządzeń na ich bazie przyznano już kilka Nagród Nobla. Mimo ich fascynujących właściwości, związki domieszkowane stanowią mniejszość wśród wielu milionów znanych (najczęściej stechiometrycznych i będących izolatorami elektryczności) substancji chemicznych. I dotychczas nie znana była żadna ogólna i prosta metoda, dzięki której można otrzymywać układy domieszkowane – mówi prof. Wojciech Grochala.
Szczególnie niepodatne na tworzenie układów domieszkowanych są wspomniane super-silne utleniacze i reduktory. Problem udało się rozwiązać naukowcom z Uniwersytetu Warszawskiego i Uniwersytetu La Sapienza w Rzymie.
Do zademonstrowania pomysłu badacze wybrali fluorek srebra dwuwartościowego, AgF2. − Jest to niezwykle reaktywny chemicznie super-utleniacz i środek fluorujący (Rys.1), używany np. w projekcie Manhattan w okresie II wojny światowej, co doprowadziło do konstrukcji pierwszej bomby atomowej. Ten ważny związek srebra był intensywnie badany przez ostatnie dwie dekady, lecz dotychczas opierał się wszelkim próbom domieszkowania – wyjaśnia prof. Grochala.

Rys.1. Przykład gwałtownej reakcji chemicznej z udziałem AgF2 (na dnie naczynia) oraz dość biernego chemicznie SiCl4 (wkraplanego kropla po kropli do naczynia; od lewej do prawej progres reakcji).
− Zaproponowaliśmy by wykorzystać nanotechnologię, a w szczególności narastanie warstw atomowych warstwa po warstwie na odpowiednim podłożu. Istotne jest przy tym, by warstwę utleniacza – AgF2 – umieścić w pewnym oddaleniu od warstwy reduktora, a obie warstwy przedzielić separatorem obojętnym z punktu widzenia reakcji redoksowych (Rys.2) – mówi prof. Wojciech Grochala.
Całość osadzona jest na odpowiednim podłożu, zaś układ może być w dalszym stopniu zmodyfikowany poprzez osadzenie na warstwie utleniacza dodatkowej warstwy zabezpieczającej. Jako reduktor badacze zastosowali tlenek magnezu, MgO. Separacja przestrzenna reagentów jest kontrolowana w skali nano poprzez użycie konkretnej liczby warstw separatora.
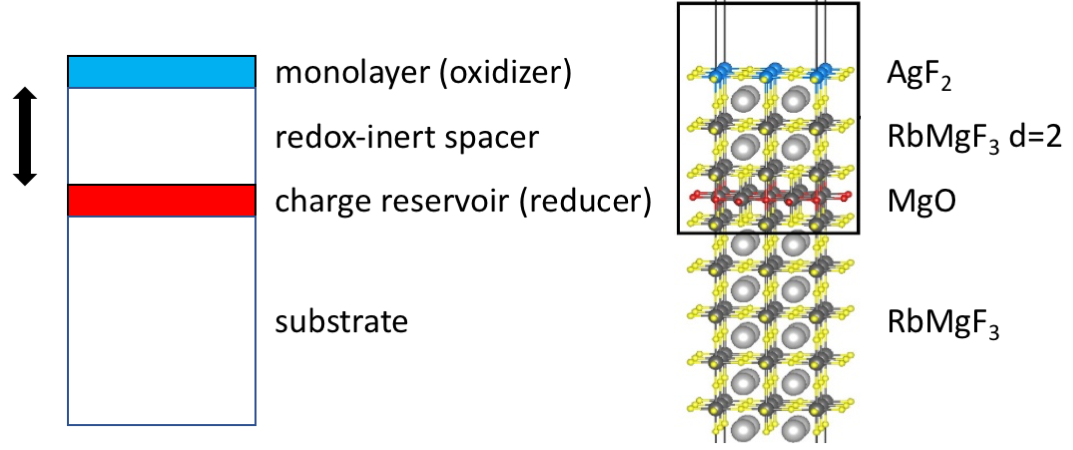
Rys.2. Ogólna konstrukcja układu do kontrolowanego wstrzykiwania ładunku do warstwy utleniacza (AgF2, kolor niebieski) z warstwy reduktora (MgO, kolor czerwony), poprzez obojętny separator o kontrolowanej grubości. Całość osadzona jest na inertnym podłożu.
− Obliczenia pokazały, że gdy odległość między reagentami maleje, rośnie stopień przeniesienia ładunku między nimi, δ, a zatem obie warstwy domieszkowane są w tym samym stopniu, tylko jedna elektronami, a druga dziurami − wyjaśnia dr Adam Grzelak.
W każdym przypadku obserwowane jest przeniesienie niecałkowitej liczby elektronów na jednostkę stechiometryczną.
Nano-urządzenie
Proponowane przez badaczy warstwowe układy specjaliści przyrównują do hybrydy ogniwa elektrochemicznego (baterii) i kondensatora, nie są one jednak prostą średnią czy sumą tych urządzeń. − Rzeczywiście, działanie tego nano-urządzenia można dobrze opisać wzorem, przypominającym równanie na ładunek zgromadzony w kondensatorze. Przy czym w miejscu napięcia elektrycznego występuje różnica potencjałów chemicznych reagentów, podobnie jak w równaniach, które opisują działanie baterii − dodaje dr José Lorenzana.
W kolejnych badaniach naukowcy będą mieli okazję sprawdzić, czy warstwowe układy domieszkowane uda się istotnie sfabrykować w laboratorium.
Źródło: uw.edu.pl


