
Leczenie zakaźnych chorób bakteryjnych w dzisiejszych czasach – na skutek rosnącej częstości występowania szczepów antybiotykoopornych – stało się istotnym wyzwaniem dla medycyny i nauk pokrewnych. Stale jednak opracowywane są nowe metody leczenia, a wśród nich na szczególna uwagę zasługuje technika wykorzystująca aptamery, które są polimerami RNA lub DNA i wykazują wysoko specyficzne powinowactwo do określonego celu molekularnego. Z tego względu pod kątem funkcjonalnym przypominają przeciwciała monoklonalne. Poprzez wiązanie z określonym celem aptamery mogą: (I) hamować aktywność toksyn bakteryjnych; (II) blokować systemy adhezji do komórek gospodarza; (III) hamować inwazję; (IV) inhibować systemy konstrukcji biofilmów; (V) stanowić platformę dostarczania chemioterapeutyków.
Aptamery – struktura i ogólne właściwości
Aptamery są krótkimi polimerami RNA lub DNA o masie molekularnej nieprzekraczającej 40 kDa. Cechą charakterystyczna aptamerów jest przyjmowanie przez nie wysoko uorganizowanej struktury przestrzennej, z której bezpośrednio wynika ich zdolność do rozpoznania celów molekularnych. Wykazują one również znaczna elastyczność i stabilność. Po częściowej denaturacji mogą przyjąć wyjściową strukturę i powinowactwo [1]. Współczesne metody syntezy chemicznej kwasów nukleinowych pozwalają nawet na zastosowanie alternatywnych nukleotydów, których obecność w polimerze zwiększa jego stabilność (uodparnia na enzymy nukleolityczne) lub zmienia właściwości rozpoznawania (zastosowanie nukleotydów o innym ładunku elektrostatycznym). Dzięki temu aptamery są znacznie bardziej różnorodnymi strukturami niż analogiczne przeciwciała monoklonalne.
Aptamery mogą być również w różnorodny sposób modyfikowane chemicznie poprzez sprzęganie kwasów nukleinowych z białkami, fluorochromami i nanocząstkami. Modyfikacji tych używa się przede wszystkim w celu zwiększenia stabilności aptamerów w krwioobiegu (zmniejszenie podatności na hydrolizę lub usuwanie wraz z moczem). Ponadto aptamery wyposażone w sprzężony fluorochrom mogą znajdować zastosowanie w obrazowaniu przyżyciowym [2].
Terapie oparte na aptamerach
Różnorodność aptamerów i możliwości ich chemicznej edycji sprawiły, że struktury te coraz częściej znajdują zastosowanie w badaniach z zakresu nauk biomedycznych.
Aptamery w terapiach biofilmów
Biofilmy bakteryjne są jednymi z form, jakie przyjmują komórki. Spotyka się je często w środowiskach naturalnych, gdzie komórki narażone są na niekorzystny wpływ wielu czynników chemicznych i fizycznych. Jednak bakterie formują biofilmy również w trakcie infekcji. Uodparnia to je – przynajmniej częściowo – na aktywność systemu odpornościowego (fagocyty, peptydy o właściwościach antybakteryjnych, wymywanie przez śluz) i antybiotyki (dzięki zbitej strukturze terapeutyki nie docierają do wszystkich komórek) [3].
Formowanie biofilmów jest złożonym procesem, który można podzielić na kluczowe etapy: (I) adhezja – przyłączenie kilku komórek do podłoża poprzez prezentowane na ich powierzchni specjalne adhezyny, połączenie to może być niespecyficzne (jak ma to miejsce w przypadku bakterii środowiskowych) lub specyficzne (typowe dla bakterii patogennych); (II) synteza polimerów zewnątrzkomórkowych – polimery zewnątrzkomórkowe są organicznym materiałem pełniącym funkcje cementu wzmacniającego i stabilizującego biofilm, w niektórych przypadkach związki te mogą oddziaływać z lekami skutecznie blokując ich dostęp do wnętrza biofilmu; (III) wzrost i specjalizacja – komórki bakteryjne po udanej adsorpcji dzielą się i umożliwiają wzrost biofilmu stabilizowanego polimerami zewnątrzkomórkowymi, jednak niektóre z komórek mogą przejść na drogę specjalizacji, która – w zależności od warunków zewnętrznych i lokalizacji w biofilmie – przystosowuje je do określonych funkcji (oporność na antybiotyki, podział, przyswajanie związków odżywczych, formowanie komórek przetrwałych) [4].
Każdy z powyższych etapów wymaga zmiany metabolizmu komórki bakteryjnej i aktywacji określonych genów, które umożliwiają prezentowanie na powierzchni komórki adhezyn lub syntezę konkretnych metabolitów. Blokada chociażby jednego czynnika skutecznie blokuje wzrost biofilmu. Wykazano na przykłąd, że zastosowanie aptameru wiążącego białka wici Salmonella choleraesuis uniemożliwia tej bakterii adhezję i oddziaływanie z innymi komórkami [5].
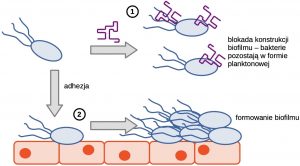
(1) Aptamery wiążą się z powierzchniowymi celami molekularnymi komórek bakteryjnych i blokują oddziaływanie patogenów z podłożem i innymi bakteriami. (2) Bakterie – które nie zostały potraktowane aptamerem – mogą wiązać się i konstruować trudne w leczeniu biofilmy.
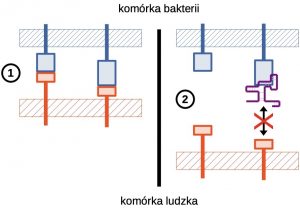
(1) Niezablokowane przez aptamer adhezyny bakteryjne rozpoznają cele molekularne na komórce gospodarza i umożliwiają wiązanie się patogenu. (2) W przypadku zablokowania adhezyny strukturą aptameru nie jest możliwe rozpoznanie celu przez bakterie i udana adhezja.
Aptamery hamujące aktywność toksyn
Toksyny bakteryjne należą do jednego z kluczowych mechanizmów wirulencji, którymi dysponują patogeny. W wielu przypadkach stanowią one jedyny czynnik odpowiadający za kliniczną manifestację choroby (np. toksyna Vibrio cholerae). Toksyny bakteryjne są bardzo różnorodne funkcjonalnie, mogą oddziaływać na komórki modyfikując ich komunikację lub bezpośrednio doprowadzać do ich śmierci. Oddziaływanie toksyny na komórce docelową wymaga specyficznych oddziaływać z jej receptorami [6, 7]. Podobnie jak w przypadku formowania biofilmów – zablokowanie oddziaływania toksyna-receptor uniemożliwia jej wpływ na komórkę gospodarza.
Jedna z lepiej zbadanych toksyn jest alfa-toksyna wytwarzana przez Staphylococcus aureus – kluczowego patogena będącego czynnikiem etiologicznym wielu infekcji szpitalnych. Wykazano skuteczną blokadę wiązania toksyn z komórkami docelowymi poprzez zablokowanie jej aptamerem [8].
Aptamer jako platforma nośnikowa
Modyfikacje chemiczne aptamerów znacznie rozszerzają i tak ogromne możliwości tych cząsteczek. Dzięki specyficznemu wiązaniu z receptorami komórkowymi i niekomórkowymi elementami tkankowymi aptamery mogą służyć jako nośniki substancji o właściwości terapeutycznej, którymi mogą być właściwe leki, ale również nanocząstki, kwasy nukleinowe itp. W większości przypadków tworzenie koniugatów ma dodatkową właściwość stabilizująca same aptamery i chroniąca je przed nukleazami tkankowymi [9].
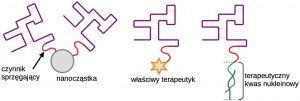
Chemiczne skoniugowane aptamerów z innymi związkami pozwala na konstruowanie stabilnych kompleksów o znacznie rozszerzonych funkcjach.
Adrian Macion
Zakład Genetyki Bakterii, Wydział Biologii, Uniwersytet Warszawski
Miecznikowa 1, 02-089 Warszawa
Bibliografia:
- Zhang Y, Lai BS, Juhas M. Recent Advances in Aptamer Discovery and Applications. Molecules. 2019;24(5):941.
- Zhu G, Niu G, Chen X. Aptamer-Drug Conjugates. Bioconjug Chem. 2015;26(11):2186-2197.
- Di Domenico EG, Farulla I, Prignano G, et al. Biofilm is a Major Virulence Determinant in Bacterial Colonization of Chronic Skin Ulcers Independently from the Multidrug Resistant Phenotype. Int J Mol Sci. 2017;18(5):1077.
- Donlan RM. Biofilms: microbial life on surfaces. Emerg Infect Dis. 2002;8(9):881-890.
- Ning Y, Cheng L, Ling M, Feng X, Chen L, Wu M, Deng L. Efficient suppression of biofilm formation by a nucleic acid aptamer. Pathog Dis. 2015 Aug;73(6):ftv034.
- Macion A, Wyszyńska A, Godlewska R. Delivery of Toxins and Effectors by Bacterial Membrane Vesicles. Toxins (Basel). 2021;13(12):845.
- Henkel JS, Baldwin MR, Barbieri JT. Toxins from bacteria. EXS. 2010;100:1-29.
- Vivekananda J, Salgado C, Millenbaugh NJ. DNA aptamers as a novel approach to neutralize Staphylococcus aureus α-toxin. Biochem Biophys Res Commun. 2014 Feb 14;444(3):433-8.
- Zhu G, Chen X. Aptamer-based targeted therapy. Adv Drug Deliv Rev. 2018;134:65-78. d
O Autorze
Student studiów magisterskich na kierunku Biologia (specjalizacja – Biologia Molekularna) na Uniwersytecie Warszawskim, Prezes Koła Naukowego Biologii Molekularnej na kadencje 2019/20 i 2020/21 i 2021/22, Prezes Koła Naukowego Astrobiologii Voyager na kadencję 2021/22, Założyciel i Redaktor Naczelny Studenckiego Czasopisma Naukowego Eureka!. Obecnie studiuje w Hiszpanii na Universitat Politecnica de Valencia w ramach studiów wymiennych ERASMUS. W ostatnich latach brał również udział w licznych kursach i wymianach organizowanych między innymi przez: Institut Pasteur w Paryżu, niemiecki Ruprecht-Karls-Universität Heidelberg, Università degli Studi di Milano czy Univerzita Karlova w Pradze. Zafascynowany bakteriami, czynnikami i molekularnymi mechanizmami ich patogenezy. Zaangażowany w edukację licealną i akademicką oraz popularyzację nauki. Uwielbia opowiadać o białkach, komórkach i ulubionych historiach Science-Fiction. W wolnych chwilach pisze książki, tatuuje się, maluje obrazy i marzy o badaniu życia na Marsie.



