
Szacuje się, że do roku 2025 wartość ogólnoświatowego rynku proteomicznego przekroczy 30 miliardów dolarów amerykańskich [1]. Jest to spowodowane zainteresowaniem firm farmaceutycznych oraz biotechnologicznych głównie w obszarach projektów badawczo – rozwojowych dotyczących medycyny spersonalizowanej i leków nowej generacji, zwłaszcza w diagnostyce oraz leczeniu chorób cywilizacyjnych czy o podłożu genetycznym (np. cukrzyca, nowotwory, mukowiscydoza, choroby neurodegeneracyjne) [2]. Wynika to także z niespotykanego dotąd rozwoju technik i metod analizy białek oraz produktów białkowych [3].
Proteomika jest nauką, która zajmuje się identyfikacją białek oraz badaniem ich ekspresji, modyfikacji, struktury i wzajemnych interakcji. Wszystkie białka organizmu, bez względu na to czy to organizm zwierzęcy czy roślinny, określa się mianem proteomu. Podlega on dynamicznym zmianom na skutek czynników wewnętrznych oraz środowiskowych, przez co stanowi znacznie większe wyzwanie dla badaczy niż statyczny i lepiej poznany genom, czyli ogół genów organizmu. Zrozumienie podłoża tych zmian stanowi podwaliny pod ustalenie mechanizmów molekularnych chorób, a poprzez znalezienie ich biomarkerów, czyli substancji, właściwości lub genów, które mogą pełnić rolę obiektywnie mierzalnych wskaźników, stworzenie skutecznych terapii [4, 5]. Bogactwo form białkowych wymusza ciągły pęd ku udoskonalaniu technik i podejść analitycznych zaczynając od proteomiki pojedynczej komórki (single cell proteomics), przez technologię równoległej akwizycji szeregowej akumulacji (PASEF) w nowych spektrometrach ruchliwości jonów (timsTOF), a kończąc na poszerzeniu możliwości w analizach ilościowych białek przez wprowadzenie 18 – kanałowych zestawów do znakowania chemicznego (TMT 18plex) [6, 7, 8, 9, 10]. Wszystko to sprawia, że jesteśmy świadkami niesamowitej ekspansji zastosowań w obszarze life-science, z których najciekawsze dotyczą leków biopodobnych (biosimilars), zanieczyszczeń biofarmaceutyków (HCP), białek terapeutycznych oraz koniugatów przeciwciało – lek (ADCs) [11, 12, 13, 14, 15, 16, 17].
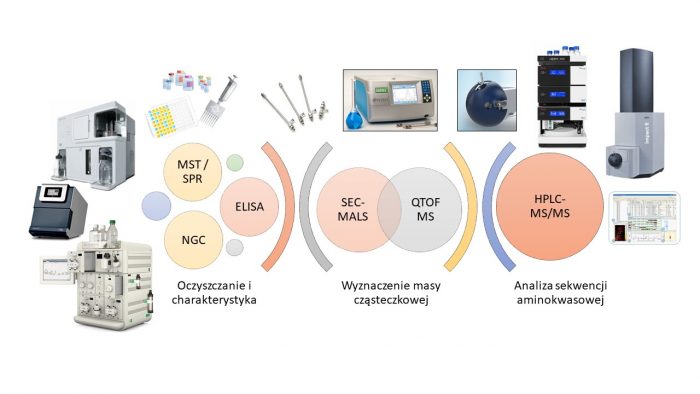
By wyjść naprzeciw oczekiwaniom klientów Laboratorium Chromatografii i Spektrometrii Mas Jagiellońskiego Centrum Innowacji (JCI) oferuje kompleksową charakterystykę białek z wykorzystaniem bogatego zaplecza aparaturowego (Rys. 1). Oferta obejmuje oczyszczenie i rozdzielenie białek z wykorzystaniem elektroforezy żelowej oraz systemów chromatograficznych nisko/średnio (NGC, Bio-Rad) i wysokociśnieniowych (UHPLC, Thermo Scientific). Na tym etapie możemy uzyskać także informację ilościową na drodze pomiaru densytometrycznego, czyli oszacować zawartość danego białka w próbce. Następnie przeprowadzana jest identyfikacja białek z wykorzystaniem specyficznych metod immunoenzymatycznych (ELISA, Western Blot) lub przez wyznaczenie masy cząsteczkowej i sekwencji aminokwasowej za pomocą wysokorozdzielczej spektrometrii mas. Dopełnieniem charakterystyki są informacje o stopniu oligomeryzacji białka uzyskiwane z pomiaru detektorem wielokątowego rozpraszania światła (MALS, Wyatt) połączonego z detektorem refraktometrycznym (RI). Ponadto istnieje możliwość wyznaczenia stałej wiązania białka z ligandem z wykorzystaniem dwóch komplementarnych technik jakimi są powierzchniowy rezonans plazmonów (SPR, Cytiva) oraz termoforeza mikroskalowa (MST, NanoTemper). W laboratorium realizowane są także analizy ilościowe z wykorzystaniem techniki UPLC-MS/MS (Thermo Scientific, Bruker) obejmujące porównanie pełnych profili białkowych w próbkach np. u osób chorych vs zdrowych, przed i po terapii (tzw. analizy shotgun). Laboratorium oferuje swoje usługi analityczne oraz wsparcie merytoryczne zarówno w projektach badawczo-rozwojowych (R&D) jak i w zakresie kontroli jakości (QC).
ROZDZIELENIE I OCZYSZCZANIE BIAŁEK
Rozdzielenie białek i peptydów, a także ich pochodnych cukrowych przed wprowadzeniem do spektrometru mas odbywa się standardowo w układzie faz odwróconych (Reverse-phase chromatography) z wykorzystaniem silnie hydrofobowych faz stacjonarnych (kolumny z wypełnieniem oktadecylowym C18) i polarnych faz mobilnych. Wybór takich kolumn chromatograficznych dostępnych na rynku jest stosunkowo duży i bywają one zróżnicowane pod względem możliwości analitycznych. W laboratorium JCI dysponujemy sześcioma wysokosprawnymi systemami chromatograficznymi (UHPLC) firmy Thermo Scientific oraz dwoma systemami firmy Hitachi. Natomiast do analizy peptydów oraz białek wykorzystujemy niezwykle odporne kolumny wyprodukowane w technologii BEH – Ethylene Bridged Hybrid Particle, umożliwiające pracę w szerokim zakresie ciśnienia (do 1200 bar) oraz pH (1-12).
Innym rodzajem chromatografii przydatnej w rozdzielaniu dużych cząsteczek jest chromatografia wykluczenia (Size-exclusion chromatography) zwana też sitem molekularnym. Przewagą tej techniki nad innymi jest zachowanie białek w ich natywnej, biologicznie aktywnej formie, gdyż nie stosujemy tu rozpuszczalników organicznych ani modyfikatorów faz. Jest to zatem doskonały sposób oczyszczenia interesujących nas białek oraz określenie ich trzecio- i czwartorzędowej struktury. W naszym laboratorium mamy do dyspozycji pakiet kolumn typu SEC, które pozwalają na rozdzielenie białek o masach w zakresie 100 – 5 000 000 Da.
W procesie oczyszczania białek wykorzystuje się ich różne właściwości fizykochemiczne: ładunek, hydrofobowość, rozpuszczalność, kształt oraz masa molowa. Dzięki posiadanemu niskociśnieniowemu systemowi chromatograficznemu NGC (Bio-Rad) mamy możliwość rozdzielenia białek w oparciu o różne mechanizmy chromatograficzne: wspomnianą już chromatografię wykluczenia (SEC), chromatografię jonowymienną (IXC), chromatografię powinowactwa (AC) oraz chromatografię hydrofobową (HIC), oczywiście wykorzystując w tym celu odpowiednio dobrane kolumny i roztwory buforowe [18]. Nasz system dodatkowo wyposażony jest w detektor UV-Vis, który pozawala ma monitorowanie czterech długości fal jednocześnie. Takie zaplecze aparaturowe wsparte doświadczeniem specjalistów pozwala nam na oczyszczanie cennych białek w skali analitycznej i pół-preparatywnej.
Proces oczyszczania białek niejednokrotnie wymaga kombinacji różnych technik separacji. Sprawdzenie czystości preparatów na poszczególnych etapach oczyszczania przeprowadzamy z wykorzystaniem denaturującej elektroforezy żelowej (SDS-PAGE). Technika ta pozwala w pełni uniezależnić proces rozdzielania białek od ich kształtu i ładunku elektrycznego, a co za tym idzie rozdzielić je zgodnie z ich masą molekularną [19]. Jest to korzystny etap przed analizą techniką spektrometrii mas, bowiem prócz oczyszczenia z detergentów zachodzi tu również zatężenie białek. Jak już wspomniano wcześniej uzyskany żel można poddać analizie densytometrycznej i w ten sposób oszacować zawartość konkretnych białek.
IDENTYFIKACJA BIAŁEK
Test immunoenzymatyczny (ELISA)
Jednym z najpowszechniej stosowanych testów w badaniach biomedycznych jest test immunoenzymatyczny (ang. Enzyme-linked immunosorbent assay). Test wykrywa określone białka w badanym materiale przy użyciu przeciwciał połączonych z enzymem i zazwyczaj przeprowadza się go na płytce 96-dołkowej. Jest to metoda bardzo czuła i specyficzna, dzięki czemu pozwala oznaczyć konkretne białko występujące w złożonej mieszaninie i to na bardzo niskim poziomie stężenia (poniżej 1 pg/mL). W laboratorium JCI oznaczamy tą metodą przeróżne białka np. cytokiny, dysmutazy czy kalprotektynę, a także białkowe zanieczyszczenia od komórek gospodarza (HCP) i alergeny w produktach spożywczych (gluten). Wykorzystujemy w tym celu komercyjne testy, a dla nietypowych problemów opracowujemy dedykowane rozwiązania.
Spektrometria mas
W jaki inny sposób naukowcy są w stanie zidentyfikować białko? Robią to poprzez chromatograficzne rozdzielenie białek w mieszaninie, rozbicie ich na mniejsze fragmenty (peptydy) i wyznaczenie ich masy. Poprzez „zważenie” każdego aminokwasu, który jest najmniejszą składową białka finalnie możliwa jest jego identyfikacja.
Podchodząc do tego zjawiska od strony technicznej spektrometria mas pozwala na wyznaczenie masy cząsteczkowej (dokładnie stosunku masy do ładunku) pojedynczego związku chemicznego lub wielu związków obecnych w mieszaninie. Jeśli taki związek celowo poddamy w spektrometrze fragmentacji to uzyskamy dodatkowe informacje o jego strukturze dzięki czemu możemy go z większym prawdopodobieństwem zidentyfikować w oparciu o dostępne bazy danych lub znaną sekwencję aminokwasową. Widząc możliwie pełną sekwencję analizowanego białka zauważymy różnice w masie, które wynikają z różnego typu modyfikacji, w tym potranslacyjnych (PTMs), a te mają bardzo ważny wpływ na funkcjonowanie białka [20].
CHARAKTERYTYKA WŁAŚCIWOŚCI FIZYKOCHEMICZNYCH BIAŁEK
Detektor wielokątowego rozpraszania światła (MALS)

Powszechną praktyką w wyznaczaniu masy cząsteczkowej białek jest zastosowanie rozdziałów na, wyżej wspomnianych, kolumnach SEC. Metoda ta stanowi prostą alternatywę dla spektrometrii mas, wymaga jednak kalibracji kolumny przy pomocy standardów o znanej masie cząsteczkowej. Może być zatem zawodna z powodu różnic w konformacji białek. Problemu tego można uniknąć sprzęgając rozdział chromatograficzny SEC z detektorem MALS. Metoda ta bazuje na zależności między ilością rozproszonego światła a masą cząsteczkową analitu. Znając stężenie białek wprowadzanych na kolumnę SEC i mierząc dla nich intensywność rozproszenia światła lasera można wyznaczyć masy cząsteczkowe wszystkich rozdzielonych składników próbki i to bez odnoszenia się do standardów mas cząsteczkowych. Metoda ta jest często wykorzystywana w kontroli jakości białek, które wchodzą w skład preparatów leczniczych. W laboratorium JCI ośmiokanałowy detektor MALS (DAWN HELEOS 8+, Wyatt) został sprzężony z detektorem refraktometrycznym (RI) oraz systemem chromatograficznym wyposażonym w detektor UV (Ultimate 3000, Thermo Scientific), co znacząco poszerza możliwości analityczne układu i pozwala wyznaczać masy białek o nieznanej sekwencji zakresie 500 Da – 1 GDa [21].
Termoforeza kapilarna (MST)

Termoforeza kapilarna służy do ilościowego określania oddziaływań międzycząsteczkowych. Pozwala na charakterystykę takich kompleksów jak: antygen-przeciwciało, białko-DNA, białko-lek, białko-metal poprzez wyznaczenie ich stałych dysocjacji. Technika ta jest oparta na zjawisku termoforezy, czyli ukierunkowanym ruchu cząsteczek w gradiencie temperatury, który silnie zależy od ich właściwości (wielkość, ładunek, powłoka hydratacyjna, konformacja), a te zmieniają się pod wpływem oddziaływania cząsteczki z ligandem. Termoforeza jest mierzona poprzez pomiar fluorescencji wewnętrznej białka lub fluoroforów związanych z nim kowalencyjnie. Zaletą tej techniki jest brak konieczności immobilizacji białka, gdyż pomiar jest wykonywany w roztworze, w warunkach zbliżonych do natywnych [22, 23].
W laboratorium JCI dysponujemy urządzeniem Monolith NT.115, które umożliwia pomiar cząsteczek o masach od 10 Da – 10 MDa w zakresie stężeń 1 nM do 1 mM. Urządzenie dysponuje dwoma kanałami fluorescencyjnym i pozwala na pracę z różnymi fluoroforami (FITC, FAM, GFP, YFP, Cy5, Alexa647).
Powierzchniowy rezonans plazmonowy (SPR)

Powierzchniowy rezonans plazmonowy jest efektem optycznym, który umożliwia badanie oddziaływań pomiędzy cząsteczkami bez konieczności ich znakowania. Jest to technika komplementarna do opisanej powyżej termoforezy kapilarnej, która pozwala na wyznaczenie stałych dysocjacji i asocjacji kompleksów, a ponadto dostarcza informacji o kinetyce wiązania. Cząsteczka białka jest w tym przypadku unieruchomiona na powierzchni sensora, który składa się z bardzo cienkiej warstwy złota nałożonej na szklane podłoże. Powierzchnia sensora może być zmodyfikowana chemicznie tak aby ułatwić immobilizację konkretnego białka np. do sensora NTA wiążą się białka posiadające metkę histydynową. Gdy białko zaadsorbowane na sensorze oddziałuje z innymi cząsteczkami, zmienia się masa sensora, co jest obserwowane jako zmiana kąta rezonansowego. Jako wynik otrzymywany jest sensogram, którego analiza umożliwia wyznaczenie parametrów termodynamicznych i kinetycznych reakcji [24, 25]. Dane uzyskane techniką SPR mają kluczowe znaczenie w wielu gałęziach przemysłu i od ponad 25 lat wykorzystywane są zarówno przez firmy z branży farmaceutycznej (Pfizer, Roche, GSK) jak również jednostki badawcze na całym świecie [26].
Laboratorium Chromatografii i Spektrometrii Mas JCI posiada urządzenie Biacore X100 (GE Healthcare), które pozwala na detekcje cząsteczek o masie powyżej 100 Da.
Hybrydowy analizator mas typu kwadrupol – czas przelotu (QTOF)

Spektrometr mas pozwala nam na analizę bardzo małych cząsteczek jak metabolity oraz wielkich oligomerów jakimi są białka, choć te dwie aplikacje wymagają odmiennych warunków pracy. W przypadku białek najbardziej interesujące jest wyznaczenie ich dokładnej masy cząsteczkowej, co wymaga wysokiej rozdzielczości. Z drugiej strony przy analizie mieszanin peptydów, gdzie identyfikujemy tysiące związków, ważnymi parametrami analizy są szybkość i czułość. Wysokorozdzielczy spektrometr (R > 60 000, dokładność pomiaru masy <1 ppm) z analizatorem kwadrupol – czas przelotu (QTOF) firmy Bruker, którym dysponujemy, pozwala na szybkie skanowanie (do 50 Hz) w zakresie mas od 20 do 50 000 m/z. Taki spektrometr jest bardzo popularny w zastosowaniach biofarmaceutycznych, ponieważ pozwala analizować oczyszczone białka w zakresie mas 5 – 150 kDa, a także skomplikowane mieszaniny peptydów pochodzące z próbek biologicznych (tkanki, płyny ustrojowe), roślinnych i hodowli komórkowych [27].
Prócz masy cząsteczkowej istotną informacją jaką możemy uzyskać z takiej analizy białka jest obecność określonych modyfikacji, jak przyłączanie reszt fosforanowych (fosforylacja) czy cukrowych (glikozylacja). Modyfikacje te mają kluczowe znaczenie dla funkcji i właściwości białek, np. zwiększają ich czas półtrwania w krwioobiegu przez przyłączenie glikolu polietylenowego (pegylacja) czy wymuszają ich degradację w wyniku przyłączenia ubikwityny [20]. Uchwycenie czasem bardzo niewielkich zmian w masie białka/peptydu wymaga starannego przygotowania próbek, w tym frakcjonowania, multienzymatycznego trawienia i wzbogacania.
W Laboratorium Chromatografii i Spektrometrii Mas Jagiellońskiego Centrum Innowacji nasi specjaliści, korzystając ze swojej wiedzy i doświadczenia oraz rozbudowanego zaplecza aparaturowego, wykorzystują liczne komplementarne metody, a czasem także tworzą całkiem nowe podejścia, by właściwie odpowiedzieć na najbardziej wymagające potrzeby swoich klientów.
dr Natalia Radczuk, dr Sylwia Świątek, Łukasz Mazurek
Zespół Laboratorium Chromatografii i Spektrometrii Mas JCI
Bibliografia
[1] https://www.marketresearchengine.com/proteomics-market-report
[2] https://www.mordorintelligence.com/industry-reports/europe-proteomics-market-industry
[3] https://www.mdpi.com/journal/ijms/special_issues/Spectrometric_Proteomics_2021
[4] https://www.sciencedirect.com/topics/biochemistry-genetics-and-molecular-biology/biomarker-research
[5] Front. Med., (2021), doi: 10.3389/fmed.2021.747333.
[7] Int J Mol Sci. (2021), 22 (19), doi: 10.3390/ijms221910750.
[8] Trends Biochem. Sci. (2021), 46 (8), doi.org/10.1016/j.tibs.2021.01.013
[10] https://www.thermofisher.com/order/catalog/product/A52045
[11] https://www.completerx.com/blog/the-promise-of-biosimilars-trends-in-2021-and-beyond/
[12] https://www.managedhealthcareexecutive.com/view/11-trends-influencing-biosimilars-2020
[13] https://www.hcp-detection.org/what-are-host-cell-proteins/
[14] https://www.biopharminternational.com/view/host-cell-protein-measurement-and-control
[15] Biopharmaceutical Applications Notebook: A Focus on Protein Therapeutics, Waters, APNT10049497.
[16] https://www.sciencedirect.com/topics/medicine-and-dentistry/antibody-drug-conjugate
[17] https://www.fiercepharma.com/special-report/top-10-antibody-drug-conjugate-contenders-2021
[18] https://laborant.pl/wspolczesne-metody-oczyszczania-bialek
[19] https://ruo.mbl.co.jp/bio/e/support/method/sds-page.html
[20] Database (2021) Vol. 2021, doi: 10.1093/database/baab012
[22] https://nanotempertech.com/monolith/
[23] J. Mol. Struct. (2014) 1077, 101–113, https://doi.org/10.1016/j.molstruc.2014.03.009
[24] https://www.bruker.com/pl/products-and-solutions/surface-plasmon-resonance.html
[25] https://www.biosensingspr.pl/technologie/zjawisko-powierzchnniowego-rezonansu-powierzchniow
[26] https://apinstruments.pl/powierzchniowy-rezonans-plazmonowy-metoda-spr/
[27] Alisa G. Woods, Costel C. Darie, 2019, Advancements of Mass Spectrometry in Biomedical Research, Springer.
