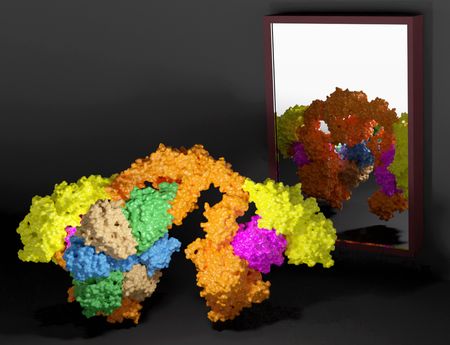
W najnowszej pracy naukowej badaczy z Małopolskiego Centrum Biotechnologii Uniwersytetu Jagiellońskiego (MCB UJ) opisano pierwszą, wysokorozdzielczą strukturę Elongatora uzyskaną przy pomocy kriomikroskopii elektronowej (cryo-EM), która rzuca światło na rolę podkompleksu Elp456. Wyniki badań zostały opublikowane w tym tygodniu w międzynarodowym czasopiśmie „Nucleic Acids Research” jako artykuł przełomowy.
Naukowcy z Grupy Badawczej Maxa Plancka w MCB UJ opisali rolę Elp456, mniejszego podkompleksu kompleksu Elongatora, ze szlaku modyfikacji tRNA. Badania grupy dr. hab. Sebastiana Glatta zostały przeprowadzone we współpracy z badaczami z Uniwersytetu w Kassel, Berlińskiego Uniwersytetu Technicznego oraz Europejskiego Laboratorium Biologii Molekularnej w Hamburgu.
Elongator jest dużym i wielopodjednostkowym (Elp1-6) kompleksem białkowym złożonym z dwóch odrębnych podkompleksów – Elp123 i Elp456. Jest odpowiedzialny za katalizę pierwszego etapu modyfikacji 34 urydyny (U34, tzw. wobble uridine), a dokładniej jej węgla w pozycji piątej, poprzez przyłączenie grupy karboksymetylowej (cm5), która to grupa ulega dalszej modyfikacji w wyniku aktywności innych enzymów. W celu zapewnienia efektywnego kotranslacyjnego fałdowania powstającego łańcucha polipeptydowego, tylko w pełni zmodyfikowane tRNA wiąże się w optymalny sposób z rybosomami biorącymi udział w translacji. Zespół dr. hab. Sebastiana Glatta przygotował wszystkie próbki w Pracowni Biologii Strukturalnej MCB UJ i zebrał większość danych przy pomocy wysokiej klasy kriomikroskopu elektronowego Titan Krios G3i, który znajduje się w Narodowym Centrum Promieniowania Synchrotronowego SOLARIS. Uzyskane dane posłużyły następnie do określenia struktur przestrzennych kilku stanów pośrednich oraz w pełni uformowanego kompleksu Elongatora z drożdży i myszy.
Uzyskane wyniki wykazały bardzo wysokie zachowanie struktury i funkcji Elongatora wśród eukariontów. Analizy in vitro i in vivo dopełniły główne ustalenia strukturalne. Pozwoliły na szczegółową charakterystykę molekularną dwóch podkompleksów Elongatora i tego, jak oddziałują one ze sobą. – Subtelne różnice strukturalne pomiędzy Elp123 związanym z tRNA a wolnym Elongatorem pozwoliły nam zaproponować funkcję Elp456, która według nas jest związana z uwalnianiem zmodyfikowanych tRNA z podkompleksu katalitycznego – dr Marcin Jaciuk, główny autor pracy.
O tym, jak ważna jest funkcja Elp456, przekonuje też dr hab. Sebastian Glatt, ostatni i korespondencyjny autor. – Porównując centra aktywne drożdżowego i mysiego Elp123 w różnych stanach aktywności, udało nam się zrobić duży, kolejny krok w scharakteryzowaniu molekularnych mechanizmów aktywności modyfikacyjnej Elongatora. Projekt, który rozpocząłem dekadę temu podczas mojego stażu podoktorskiego w EMBL, wreszcie osiągnął swój cel, jakim jest zrozumienie, jak wygląda i działa ten ważny kompleks białkowy – mówi dr hab. Sebastian Glatt.
Praca „Cryo-EM structure of the fully assembled Elongator complex” została wsparta z grantu Narodowego Centrum Nauki, European Research Council w ramach programu Unii Europejskiej Horyzont 2020 oraz programu innowacyjnego Fundacji na rzecz Nauki Polskiej.
Źródło: Łukasz Wspaniały/ uj.edu.pl
fot.: uj.edu.pl


