
Spektroskopia ramanowska (RS) zaliczana jest do metod spektroskopii oscylacyjnej, która opiera się na zjawisku nieelastycznego rozpraszania światła do wyznaczania energii przejść oscylacyjnych. Rozpraszanie nieelastyczne oznacza, że energia światła rozproszonego różni się od energii światła padającego. Jej ubytek (lub nadmiar – efekt rzadziej wykorzystywany ze względu na mniejsze prawdopodobieństwo), rejestrowany przez detektor, najczęściej kamerę CCD, jest charakterystyczny dla każdego rodzaju drgania własnego cząsteczki aktywnego w RS. Umożliwia to identyfikację ugrupowania chemicznego od którego pochodzi, a w konsekwencji identyfikację badanego materiału. Z tego względu spektroskopia ramanowska jest znakomitą metodą do analiz jakościowych.
Jedną z największych zalet RS jest brak konieczności specjalnego przygotowywania próbek, co znacznie minimalizuje ryzyko wprowadzenia zanieczyszczeń czy też zmiany w strukturze fizycznej i chemicznej badanego obiektu, jak również ułatwia i przyspiesza analizę. W odróżnieniu od spektroskopii w podczerwieni, woda nie stanowi utrudnienia w pomiarach wykonywanych techniką RS, w związku z czym mogą być one prowadzone dla roztworów wodnych. Co więcej, nie występuje konieczność wprowadzania atmosfery gazów obojętnych. Z drugiej strony materiały wykazujące fluorescencję przy oddziaływaniu ze światłem laserowym, wykorzystywanym w RS, w znacznym stopniu utrudniają pomiary ramanowskie ze względu na konkurujący charakter obydwu efektów.
W ostatnich latach spektroskopia ramanowska jest szeroko wykorzystywana, szczególnie w przemyśle farmaceutycznym. Znalazła zastosowanie między innymi w identyfikacji substancji czynnych i substancji pomocniczych nie tylko dla końcowych form leków, ale również na etapie ich projektowania zarówno w przypadku układów takich jak tabletki, proszki, maści czy też zawiesiny i kremy. Obecnie stosowana jest również w kontroli jakości, identyfikacji form polimorficznych substancji aktywnych oraz w badaniu procesów związanych z przemianami form polimorficznych. Ponadto, technika ta często jest wykorzystywana do sprawdzania równomierności rozmieszczenia API i substancji pomocniczych w formach końcowych leków, tworzenia się aglomeratów, oceny równomierności i powtarzalności procesu powlekania tabletek czy też w kontroli stabilności gotowych produktów.
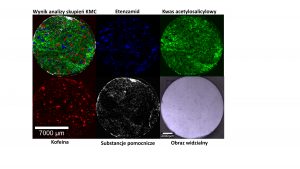
Poniżej omówimy kilka różnorodnych przykładów zastosowania spektroskopii ramanowskiej jako użytecznego narzędzia w badaniach produktów farmaceutycznych, które są realizowane w Laboratorium Obrazowania Jagiellońskiego Centrum Innowacji. W pierwszej kolejności przedstawimy analizę dystrybucji substancji aktywnej oraz substancji pomocniczych dla jednej z dostępnych na rynku tabletek przeciwbólowych. Pomiary te zostały wykonane z wykorzystaniem ramanowskiego mikroskopu konfokalnego z opcją TrueSurface® – Topographic Confocal Raman Imaging firmy WITec (Ulm, Germany). Jest to system mikroskopowo-spektroskopowy służący do nieniszczącej i nieinwazyjnej oceny chemicznej oraz topograficznej próbek stałych w trzech wymiarach. W tym przypadku kluczowym elementem obrazowania jest detektor topograficzny, który działa w oparciu o zasadę aberracji chromatycznej. Jest to bezkontaktowa, czysto optyczna technika profilometrii, pozwalająca na szczegółowe badanie topografii próbki, która jest skorelowana z pomiarami ramanowskimi. Takie połączenie pozwala na pomiary próbek charakteryzujących się nierówną lub nawet pochyłą powierzchnią, nie tracąc przy tym informacji chemicznej. W efekcie umożliwia -wierne odzwierciedlenie dystrybucji przestrzennej badanych substancji. Na rysunku 1 przedstawiono rozmieszczenie substancji aktywnych, w tym przypadku: kwasu acetylosalicylowego i kofeiny w tabletce Etopiryny.
Badania prowadzone w dziedzinie farmacji obejmują nie tylko produkty końcowe w postaci tabletek, dla których omówione zostało zastosowanie spektroskopii ramanowskiej. Istotną część sektora farmaceutycznego stanowią produkty w postaci sypkiej – czy to surowce użyte w procesie wytwarzania leków czy też produkty końcowe. Postęp w systemie dostarczania leków wymaga często zatem scharakteryzowania proszków i cząsteczek wykorzystywanych w dalszych procesach, bądź występujących w obrębie produktu gotowego. Nowym rozwiązaniem pomocnym w tego typu badaniach jest oprogramowanie ParticleScout® do spektrometrów ramanowskich WITec. Jest to narzędzie służące do obrazowania ramanowskiego, które pozwala na identyfikację, klasyfikację i analizę cząsteczek w próbkach. Warto podkreślić, że w przypadku takich analiz próbki mogą mieć zarówno formę stałą jak i być zawieszone w roztworach lub żelach. ParticeScout® umożliwia przeprowadzenie szeregu różnorodnych badań, w oparciu o które możliwe jest uzyskanie ogólnej informacji o składzie badanej próbki, a także szczegółowa analiza wybranej wielkości fizycznej, np. rozmiaru cząstek, nie tracąc jednocześnie możliwości precyzyjnej identyfikacji chemicznej. Jako wynik otrzymujemy raport, który określa ilościowo rozkład wybranych cząstek w próbce. Na rysunku 2 przedstawiony został przykładowy raport uzyskany z wykorzystaniem ParticleScout® do analizy zawartości kapsułki twardej Ketonalu.

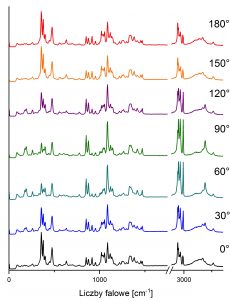
Jedną z możliwości, jakie oferuje mikroskop ramanowski WITec alpha 300R jest pomiar substancji przy różnej polaryzacji światła, tj. przy różnym kierunku drgań wektorów pola elektrycznego i magnetycznego fali świetlnej, w tym przypadku – światła laserowego. Do uzyskania światła spolaryzowanego liniowo (w którym drgania zachodzą wyłącznie w jednej określonej płaszczyźnie) w wybranym kierunku wykorzystuje się płytkę półfalową. Jej zadaniem jest rozdzielenie promienia światła laserowego na dwa promienie o tym samym kierunku, ale prostopadłych do siebie polaryzacjach, poruszających się z minimalnie różnymi prędkościami, co powoduje przesunięcie polaryzacji jednej względem drugiej. W konsekwencji różnic w prędkości ich rozchodzenia, płaszczyzna polaryzacji ulega skręceniu o dany kąt, który zawsze jest dwukrotnie większy niż kąt przekręcenia płytki półfalowej w spektrometrze. Pomiary polaryzacyjne znajdują zastosowanie w określaniu orientacji oraz geometrii ułożenia wiązań chemicznych w sieci krystalicznej, ciekłych kryształach, materiałach amorficznych, polimerach oraz substancjach biologicznych, takich jak cukry, kwasy nukleinowe czy białka. Na rysunku 3 zestawione zostały widma ramanowskie zarejestrowane przy różnych kątach polaryzacji dla cząsteczki laktozy. Dzięki analizie otrzymanych widm możliwe jest określenie orientacji wiązań chemicznych wchodzących w skład tego dwucukru, ocena stopnia krystaliczności a także odróżnienie od siebie anomerów i formy amorficznej od krystalicznej.
Różne formy polimorficzne można napotkać w przypadku badań dystrybucji API i substancji pomocniczych w produktach końcowych w postaci tabletek czy proszków, oraz pomiarów polaryzacyjnych prowadzonych dla badanych cząsteczek. Występowanie form polimorficznych jest istotną cechą zarówno dla substancji aktywnych jak i pomocniczych. Należy zaznaczyć, iż polimorfizm odnosi się tylko do substancji będących w fazie stałej i wpływa między innymi na takie parametry jak: temperatury topnienia i sublimacji, gęstość, twardość, kolor, współczynnik załamania światła, kształt kryształu, rozpuszczalność, stabilność, higroskopijność czy biodostępność. Istnieje kilka metod, które umożliwiają badanie zjawiska polimorfizmu. Jedną z nich jest spektroskopia ramanowska, która szybko i niedestrukcyjnie pozwala określić formy polimorficzne. Jest to możliwe dlatego, że znacząco różnią się one od siebie profilem spektralnym. Badania te można prowadzić nie tylko dla wzorców, ale również dla produktów końcowych w celach sprawdzenia, która forma polimorficzna dominuje w badanym układzie. Analizy z wykorzystaniem spektroskopii ramanowskiej pozwalają również na kontrolowanie stabilności form polimorficznych w procesie wytwarzania produktu końcowego.
Powyższe przykłady wskazują na szeroki wachlarz możliwości zastosowania spektroskopii ramanowskiej do badań w przemyśle farmaceutycznym, począwszy od nadzoru nad czystością i jakością surowców wyjściowych wykorzystanych do produkcji leków, poprzez monitorowanie całego procesu ich wytwarzania, aż po kontrolę jakości gotowych produktów.
dr Emilia Staniszewska-Ślęzak, dr Ewelina Wiercigroch, dr Jakub Dybaś
Jagiellońskie Centrum Innowacji
