Na przestrzeni ostatnich lat jedną ze szczególnie ważnych i dynamicznie rozwijających się gałęzi przemysłu farmaceutycznego jest produkcja leków generycznych. Leki te stanowią odpowiedniki oryginalnych produktów, dla których ochrona patentowa wygasła, identyczne pod względem dawki i formy substancji aktywnej (z ang. active pharmaceutical ingredient, API).[1] Inne firmy mogą rozpocząć produkcję danego leku po okresie ochrony trwającym zwyczajowo 20 lat, zwiększając tym samym jego konkurencyjność na rynku. Niesie to ze sobą szereg zalet, od niższych kosztów dla pacjenta, po wprowadzanie innowacyjnych rozwiązań w kwestii produkcji lub doboru składników pomocniczych. Przekłada się to często na poprawę efektów terapeutycznych. Z uwagi na ochronę patentową, nawet po jej wygaśnięciu, firmy farmaceutyczne są skazane na odtwórcze opracowanie składu oraz technologii wytwarzania danego produktu. Staje się to często dużym wyzwaniem z uwagi na wymagania dotyczące bioekwiwalencji oraz biorównoważności leków oryginalnych i generycznych.[2] Z pomocą w tym zakresie przychodzi inżynieria odwrotna (ang. reverse engineering), której zadaniem jest „odszyfrowanie” formulacji leku oryginalnego poprzez precyzyjną i wieloetapową analizę gotowego produktu. Podstawą inżynierii odwrotnej jest ustalenie składu jakościowego i ilościowego leku oryginalnego, charakterystyka formy API wraz z informacją o jego dystrybucji oraz próba prześledzenia krok po kroku procesów technologicznych wykorzystanych podczas wytwarzania danego produktu.[3]
Jednym z cenniejszych narzędzi w inżynierii odwrotnej leków okazała się spektroskopia rozpraszania ramanowskiego (RS). Technika ta z powodzeniem może być wykorzystywana m.in. do identyfikacji składników, weryfikacji tożsamości chemicznej surowców, rozróżniania form polimorficznych, a także analizy dystrybucji oraz wielkości cząstek poszczególnych substancji wchodzących w skład danego produktu. Metoda ta wykorzystuje efekt nieelastycznego rozpraszania światła do detekcji energii drgań pomiędzy atomami [4, 5] Pozwala to na analizę molekularną badanych układów, a w dalszej kolejności identyfikację mierzonych substancji. Odbywa się to poprzez porównanie uzyskanego sygnału z widmami ramanowskimi substancji wzorcowych, danymi zawartymi w odpowiednich bazach danych, bądź w oparciu o dostępną literaturę. Nowoczesne spektrometry ramanowskie mogą być dodatkowo sprzężone z mikroskopem konfokalnym, umożliwiając wykonanie mapowania ramanowskiego, tj., zbierania widm punkt po punkcie z zaznaczonego obszaru w celu uzyskania obrazów ramanowskich. Konfokalna mikroskopia ramanowska łączy w sobie zalety obydwu urządzeń – dostarcza informacje o dystrybucji przestrzennej składników przy równoczesnej identyfikacji chemicznej substancji w obrębie próbki.[5, 6] Możliwe jest zatem uzyskanie precyzyjnej informacji dotyczącej dystrybucji przestrzennej każdej zidentyfikowanej substancji, co może być pomocne nie tylko w ocenie rozmieszczenia API i substancji pomocniczych w leku, ale przede wszystkim w zrozumieniu procesu technologicznego. Analizy obrazów ramanowskich mogą być użyteczne również przy identyfikowaniu niepożądanych zanieczyszczeń. Na podstawie porównania stosunku widm ramanowskich odpowiednich substancji do wszystkich widm zarejestrowanych w obrębie mapy, możliwe jest ponadto dostarczenie pół-ilościowej informacji o procentowej zawartości składnika w zmierzonej próbce. Wśród najważniejszych zalet tej techniki wymienia się przede wszystkim jej nieniszczący charakter oraz ograniczony do minimum proces przygotowania próbki do analizy.
Obok RS, przydatnym narzędziem analizy w inżynierii odwrotnej leków, jest skaningowa mikroskopia elektronowa (SEM). Jest to technika mikroskopowa, która wykorzystuje zogniskowaną wiązkę elektronów do uzyskiwania szczegółowych obrazów o bardzo wysokiej rozdzielczości. Skanowanie próbki wiązką elektronów generuje na jej powierzchni dodatkowy ładunek elektryczny, co narzuca wymaganie, by badane próbki cechowały się odpowiednim przewodnictwem.[7] W przeciwnym razie, kumulujący się ładunek na powierzchni próbek nieprzewodzących znacząco utrudnia obrazowanie, a w szczególnych przypadkach całkowicie je uniemożliwia. W ostatnich latach opracowano jednak metody, które radzą sobie z tym problemem. Jedna z nich polega na wprowadzeniu do komory pomiarowej pary wody, która neutralizuje gromadzące się ładunki. Dodatkowo coraz więcej uwagi poświęca się obrazowaniu niskoenergetycznemu, które pozwala ominąć wiele problemów związanych z brakiem przewodnictwa lub wysoką wrażliwością na wiązkę elektronową badanego materiału. [7, 8] Rozdzielczość współczesnych mikroskopów SEM osiąga wartości subnanometryczne, co pozwala na obrazowanie najdrobniejszych detali występujących na próbce. Dodatkową zaletą SEM, jest możliwość wykorzystania mikroanalizy rentgenowskiej do określenia składu pierwiastkowego próbki od berylu wzwyż (najnowsze detektory bezokienkowe pozwalają na rejestrację sygnału już od litu).[9]
Obydwie techniki wykorzystano do uzyskania informacji o dwóch gotowych produktach, zawierających tę samą substancję aktywną – omeprazol, w celu porównania ich składu jakościowego pod kątem substancji pomocniczych oraz wykazania ewentualnych różnic w procesach technologicznych. Wyniki analiz przedstawiono na Rysunkach 1–3.
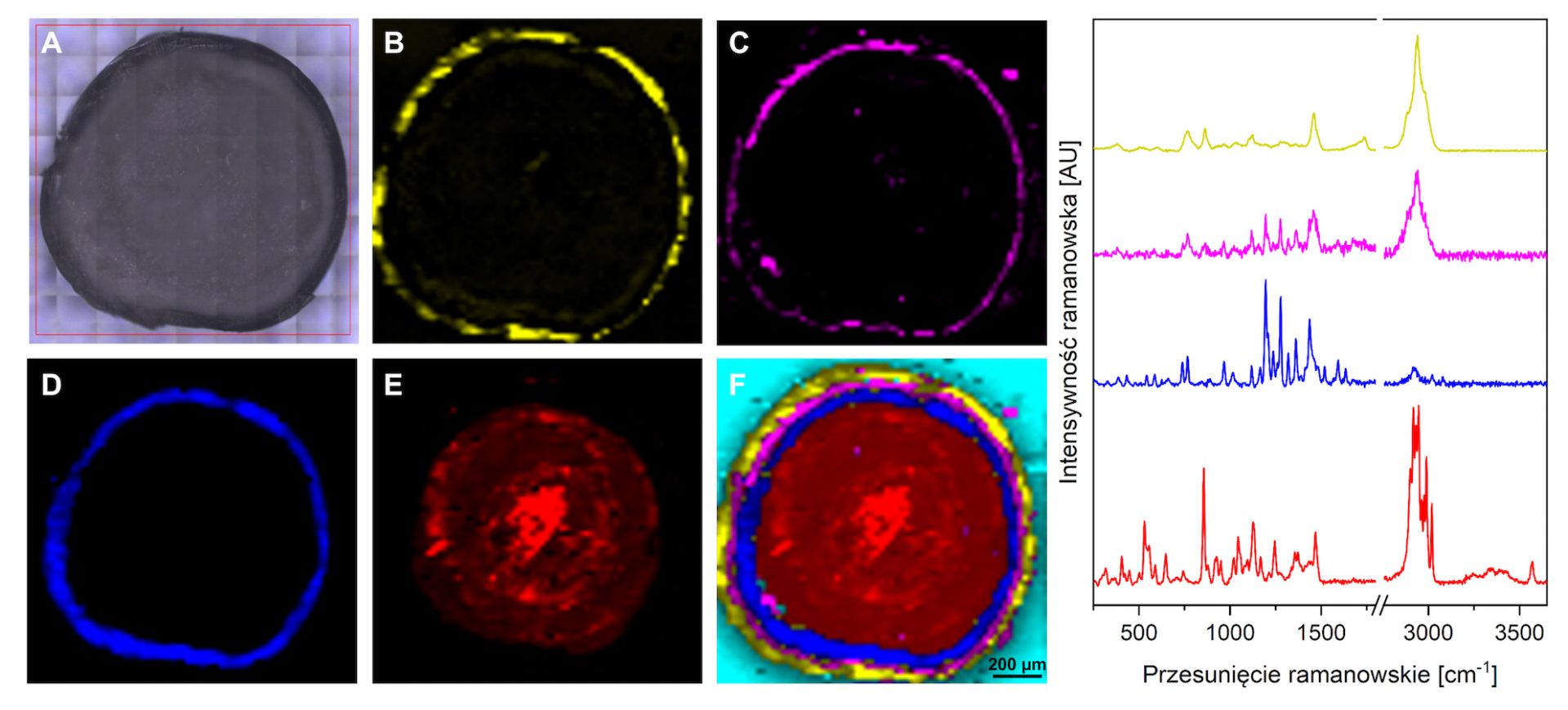
Rysunek 1. Obraz widzialny przekroju poprzecznego Produktu 1 (A, powiększenie ×20); obrazy ramanowskie przedstawiające dystrybucję przestrzenną zidentyfikowanych substancji (B–F): kopolimeru kwasu metakrylowego i etylu akrylanu (B, kolor żółty) wchodzących w skład otoczki, warstwę pośrednią zawierającą kopolimer oraz omeprazol (C, kolor różowy), API – omeprazol (D, kolor niebieski), sacharozę (E, kolor czerwony) oraz złączenie wszystkich substancji na jednym obrazie zgodnie z kolorami opisanymi powyżej (F). Po prawej umieszczono widma ramanowskie, które umożliwiły przeprowadzenie identyfikacji substancji. Kolory widm odpowiadają kolorom substancji przedstawionym na obrazach ramanowskich.
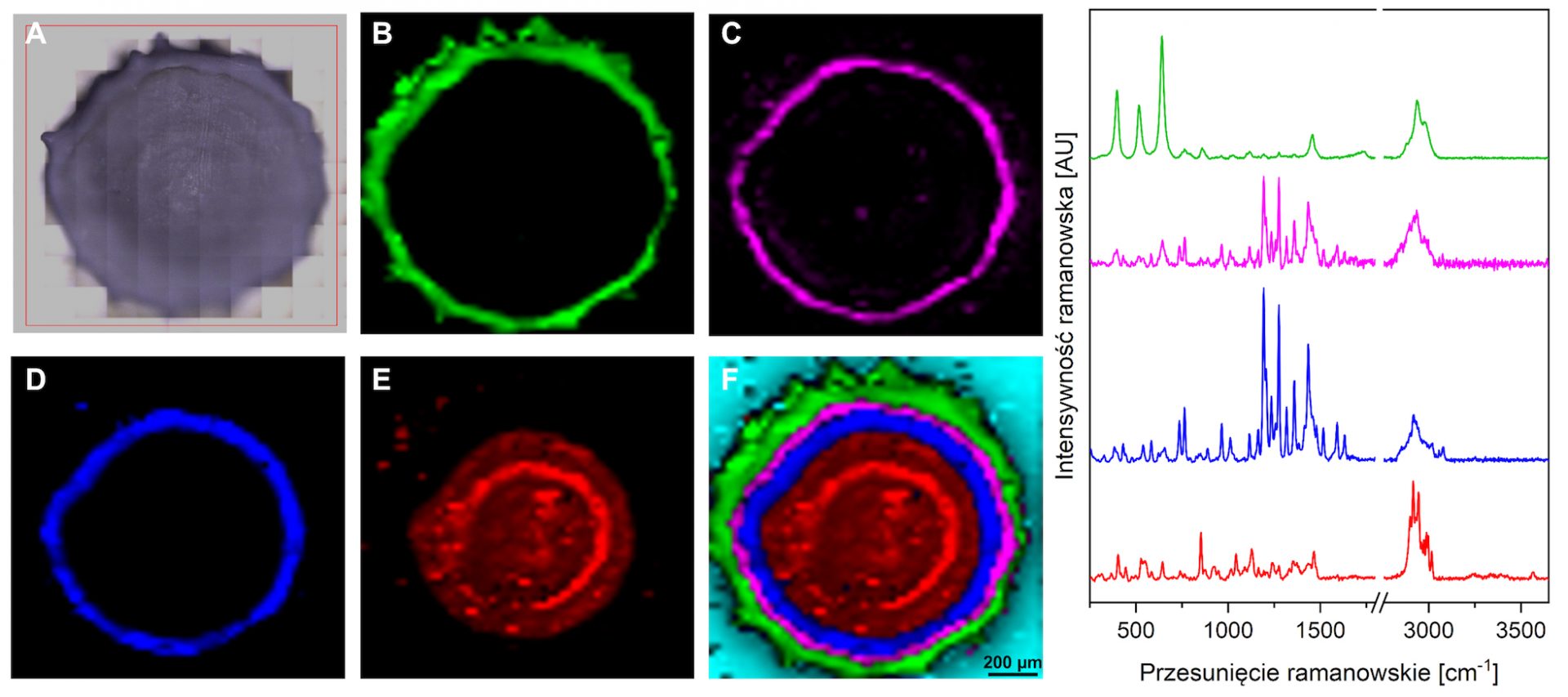
Rysunek 2. Obraz widzialny przekroju poprzecznego Produktu 2 (A, powiększenie ×20); obrazy ramanowskie przedstawiające dystrybucję przestrzenną zidentyfikowanych substancji (B–F): tlenku tytanu oraz kopolimeru kwasu metakrylowego i etylu akrylanu (B, kolor zielony) wchodzących w skład otoczki, warstwę pośrednią zawierającą kopolimer oraz omeprazol (C, kolor różowy), API – omeprazol (D, kolor niebieski), sacharozę (E, kolor czerwony) oraz złączenie wszystkich substancji na jednym obrazie zgodnie z kolorami opisanymi powyżej (F). Po prawej umieszczono widma ramanowskie, które umożliwiły przeprowadzenie identyfikacji substancji. Kolory widm odpowiadają kolorom substancji przedstawionym na obrazach ramanowskich.
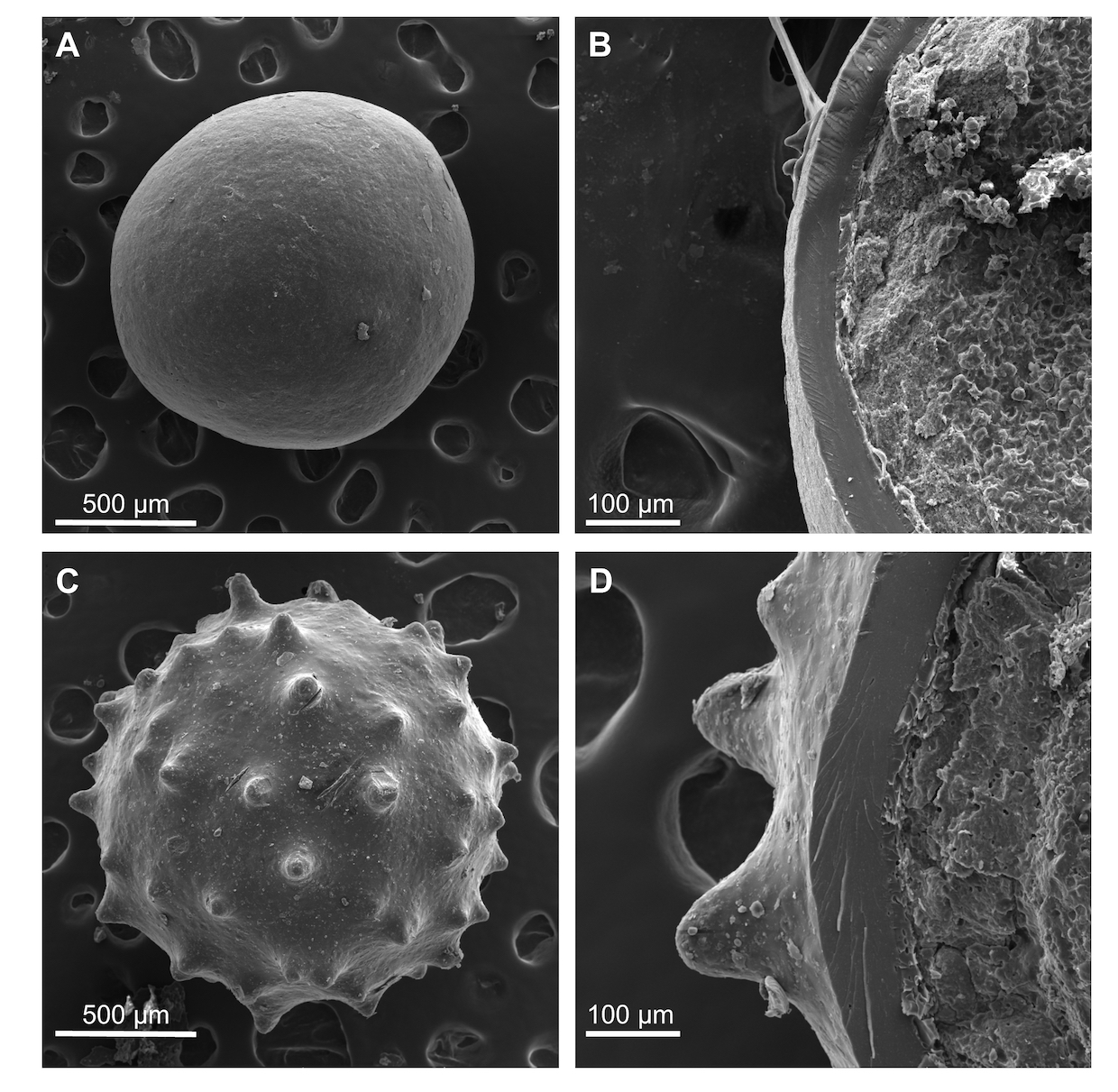
Przeprowadzone pomiary mapowania ramanowskiego pozwoliły na zidentyfikowanie substancji wchodzących w skład Produktu 1 i 2 oraz na wizualizację ich dystrybucji przestrzennej. Na podstawie charakterystycznych pasm obecnych na widmach ramanowskich, możliwe było rozróżnienie m. in. omeprazolu, sacharozy, tlenku tytanu czy kopolimeru kwasu metakrylowego i etylu akrylanu. W obydwu przypadkach wykazano, że API jest rozmieszczone dookoła substancji wypełniającej – sacharozy, a grubość warstwy z substancją aktywną jest na podobnym poziomie. Co ciekawe, badanie pozwoliło również na wykazanie różnic w procesie technologicznym wytwarzania obydwu produktów. W przypadku Produktu 1 otoczka zawiera wyłącznie kopolimer kwasu metakrylowego i etylu akrylanu, podczas gdy w skład otoczki Produktu 2 wchodzi dodatkowo tlenek tytanu. Otoczka Produktu 2 cechuje się ponadto znacznie większą grubością, co potwierdzono dodatkowo z wykorzystaniem SEM (Rysunek 3).
Rysunek 3. Zdjęcia SEM dla Produktu 1 (A, B) oraz Produktu 2 (C, D)
Podsumowując, spektroskopia ramanowska wraz ze skaningową mikroskopią elektronową stanowią silne wsparcie dla inżynierii odwrotnej leków. Obrazowanie ramanowskie dostarcza informacje o dystrybucji przestrzennej składników wchodzących w skład produktu przy ich jednoczesnej identyfikacji i rozróżnieniu. Na podstawie obrazów SEM można dodatkowo uzyskać informacje m.in. o grubości poszczególnych warstw w leku, morfologii próbki czy też jej porowatości. Stanowi to doskonałe uzupełnienie do informacji uzyskanych z obrazów ramanowskich. Łącząc zalety obydwu technik można otrzymać niezwykle cenne wskazówki dotyczące procesu technologicznego wytwarzania danego wyrobu m.in. sposobu powlekania, oszacowania stopnia rozdrobnienia składników czy ustalenie sposobu ich wymieszania. Dodatkowo, dzięki mapom ramanowskim, możliwe jest rozróżnienie form polimorficznych substancji aktywnej bądź składników pomocniczych. Powyższe informacje przyczyniają się do opracowywania innowacyjnych postaci leku – bardziej bezpiecznych dla pacjenta i o zwiększonej efektywności.
dr Ewelina Wiercigroch, dr Jakub Dybaś, dr inż. Michał Pacia
Jagiellońskie Centrum Innowacji
Referencje
- Lewek P (2009) Leki generyczne w praktyce lekarza rodzinnego. 266–271
- Sun N, Chang L, Lu Y, Wu W (2022) Raman Mapping-Based Reverse Engineering Facilitates Development of Sustained-Release Nifedipine Tablet. Pharmaceutics 14
- Bansal A, Koradia V (2005) The Role of Reverse Engineering in the Development of Generic Formulations. Pharm Technol 29
- Baranska M (2014) Optical spectroscopy and computational methods in biology and medicine. Springer Netherlands, Dordrecht
- Malek K (2016) Vibrational Spectroscopy. From theory to practise. PWN, Warszawa
- Dybas J, Marzec KM, Pacia MZ, et al (2016) Raman spectroscopy as a sensitive probe of soft tissue composition – Imaging of cross-sections of various organs vs. single spectra of tissue homogenates. TrAC – Trends Anal Chem 85:117–127
- (2020) https://lifescience.pl/miesiac-partnera-klastra/skaningowy-mikroskop-elektronowy-sem/
- Danilatos GD (1993) Bibliography of environmental scanning electron microscopy. Microsc Res Tech 25:529–534
- Mark G, Hamley IW, Kelsall RW (2012) Nanotechnologie