Nie wszystkie metale są sobie równe
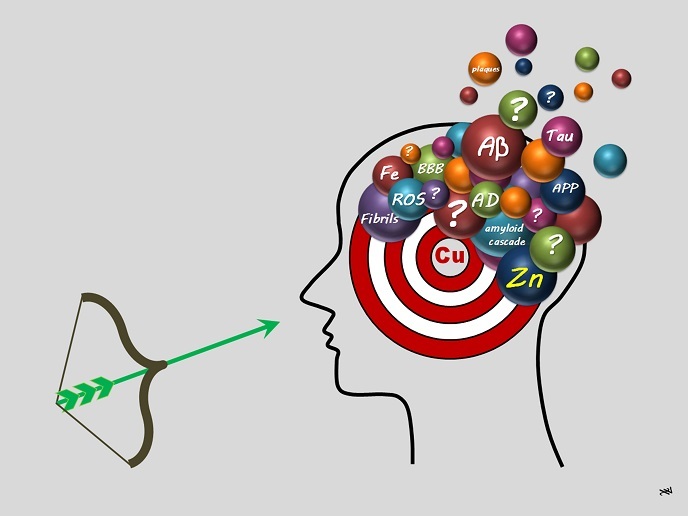
Przez ostatnie 30 lat głównym przedmiotem badań dotyczących choroby Alzheimera była hipoteza kaskady amyloidowej. Zakłada ona, że wczesnym, a zarazem pierwszym kluczowym wydarzeniem w rozwoju tej choroby jest agregacja peptydów beta-amyloidowych (Aβ) (peptydy składające się z co najmniej dwóch aminokwasów połączonych w łańcuch). Drugim wydarzeniem jest wytwarzanie reaktywnych form tlenu (ang. reactive oxygen species, ROS) wskutek stresu oksydacyjnego. W końcowym etapie samoczynnie zgrupowane peptydy gromadzą się w tzw. blaszkach starczych, co jest charakterystyczne dla tej choroby. Ze wszystkimi z tych trzech etapów powiązano homeostazę metali (utrzymanie odpowiedniej równowagi metali wymaganej do fizjologicznego funkcjonowania), w szczególności miedzi (Cu) i cynku (Zn). Stypendystka ERBN, Christelle Hureau-Sabater, wyjaśnia: „Miedź może występować w dwóch stopniach utlenienia: Cu+ i Cu2+. Podczas gdy miedź może powodować wytwarzanie ROS, cynk jest chemicznie obojętny i nie ma on takiej możliwości. Oba jony mogą łączyć się z peptydami Aβ, choć w różny sposób, tym samym modulując agregację peptydów Aβ w odmienny sposób. Jedna ze strategii terapeutycznych polega na usuwaniu jonów metali związanych z peptydami Aβ. Wysunęliśmy hipotezę, według której miedź powinna być selektywnie usuwana, co utrudnia tworzenie cząsteczek terapeutycznych/potencjalnych środków leczniczych (zwanych ligandami lub chelatorami)”. Celem projektu aLzINK jest opracowanie wytycznych, w jaki sposób tego dokonać.
Pokonywanie wyzwań, strzał w terapeutyczną dziesiątkę
Peptyd Aβ jest krótkim, inherentnie nieuporządkowanym białkiem składającym się z około 40 aminokwasów, pochodzącym z białka błonowego o dłuższej strukturze. Jego elastyczność i brak wstępnie ukształtowanej struktury przestrzennej utrudniają określenie, w którym miejscu i w jaki sposób miedź i cynk wiążą się z peptydem. Jak mówi Hureau-Sabater, „poradziliśmy sobie z tą trudnością, stosując wiele wzajemnie uzupełniających się technik, w tym skomplikowaną technikę spektroskopii rentgenowskiej”. Technikę tę powszechnie wykorzystuje się do określania miejscowej geometrycznej i/lub elektronicznej struktury materii w oparciu o promieniowanie synchrotronowe w celu uzyskania intensywnych i możliwych do przestrojenia promieni rentgenowskich. Dzięki innowacyjnym protokołom i współpracy z innymi grupami zespół Hureau-Sabater pokonał wszystkie wyzwania, z powodzeniem realizując swoje założone cele. „Dokładnie wyjaśniliśmy, dlaczego na celowniku środków kandydujących do miana leków na chorobę Alzheimera powinna znaleźć się właśnie miedź. Przeprowadziliśmy testy na różnych cząsteczkach w roztworach i komórkach, w których uzyskaliśmy obiecujące rezultaty”. Stanowi to punkt wyjścia dla przyszłych badań nad potencjałem terapeutycznym chelatorów (czynników chelatujących) miedzi i związków pokrewnych. Przy okazji naukowcy zwrócili również uwagę na użyteczność stosowania nieorganicznych proleków zamiast czysto organicznych ligandów macierzystych i odkryli znaczenie szybkości wymiany pomiędzy ligandami Aβ, miedzią i cynkiem oraz ukierunkowania miedzi na stopień utlenienia Cu+. Hureau-Sabater podsumowuje: „Wiele metod leczenia choroby Alzheimera okazało się nieskuteczne, w tym te ukierunkowane na jony metali. W ramach projektu aLzINK udowodniliśmy, że pod uwagę należy wziąć wiele kryteriów i wyjaśniliśmy ich istotne cechy”. Projekt aLzINK otworzył nowe możliwości w zakresie bardziej precyzyjnych terapii celowanych do leczenia choroby Alzheimera, które mogą zwiększyć korzyści przy jednoczesnym zminimalizowaniu zbędnych skutków ubocznych.
Źródło: cordis.europa.eu

